Puentes salinos de larga duración proporcionan el mecanismo de anclaje de las proteínas oncogénicas KRas-4B a las membranas celulares
30/12/2020
Huixia Lu y Jordi Marti del group de investigación SIMCOM del departamento de Física publican un artículo sobre el mecanismo de anclaje a la membrana celular de ciertas proteines relevants por estudios oncológicos
La oncología es una rama de la medicina que estudia los tumores benignos y malignos; los últimos conocidos como cánceres. La oncología empieza con la prevención, destinada a reducir la incidencia del cáncer, siguiendo con la asistencia a los enfermos y, finalmente, se completa con la investigación, que se ocupa del estudio de todos los elementos que intervienen en el desarrollo de las dolencias malignas y sus tratamientos.
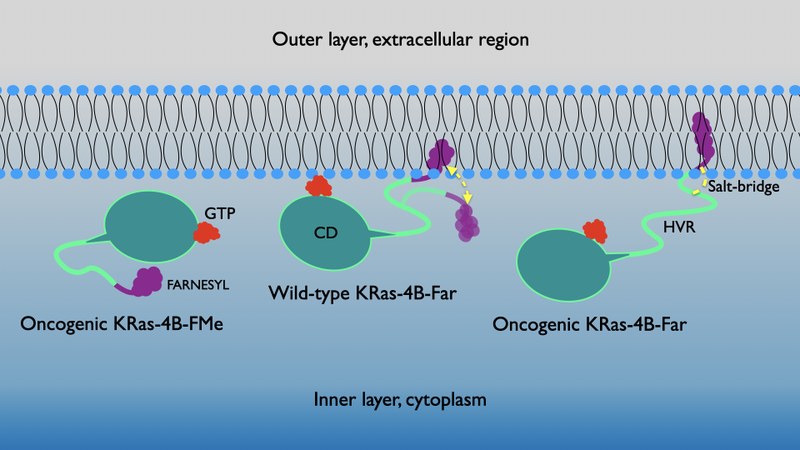
Las proteínas Ras, junto con el gen que lleva el mismo nombre, son un conjunto de interruptores-reguladores moleculares muy importantes en una gran variedad de rutas de transmisión de señales celulares que controlan diferentes fenómenos como por ejemplo la integridad del citoesqueleto, la proliferación, diferenciación, adhesión y migración celular y la apoptosis. Tanto el gen como las proteínas Ras relacionadas, a menudo están alterados en una gran variedad de tumores malignos, provocando un aumento en la capacidad de invasión y metástasis, y una disminución de la apoptosis. En particular, las proteínas Ras están directamente involucradas en los cánceres de pulmón, colon y páncreas. Dichas proteínas funcionan como conmutadores binarios entre guanosina-difosfatasa y guanosina-trifosfatasa (GDP-GTP) y son capaces de regular las redes de señalización citoplasmática que controlan varios procesos celulares, jugando un papel esencial en la señalización de vías de transducció implicadas en el crecimiento, la diferenciación y la supervivencia celular, de tal manera que se cree que la señalización excesiva es el que puede provocar el crecimiento de los tumores. Uno de los retos más difíciles de afrontar es el diseño de mutaciones selectivas que lleven a estrategias terapéuticas eficientes. En este trabajo, la proteína ligada a GTP "Kirsten rat sarcoma" (KRas-4B) con cola farnesilada y mutada al aminoácido G12 ha sido simulada a la interfaz de un modelo de membrana celular aniónica (DOPC/DOPS/colesterol). Mediante simulaciones de dinámica molecular y metadinàmica, un puente salino específico de larga duración entre el grupo farnesil y la región hipervariable de la proteína se ha identificado como el principal mecanismo responsable de la unión de la KRas-4B a la membrana celular. Las hipersuperfícies de energía libre han permitido caracterizar sus mínimos globales y locales, los cuales nos revelan las vías principales de transición entre estados anclados y no-anclados.
El resultados han sido publicados recientemente en el artículo con título: "Puentes salinos de larga duración proporcionan el mecanismo de anclaje de las proteínas oncogénicas KRas-4B en las membranas celulares" en la revista The Journal of Physical Chemistry Letters. La referencia en el artículo es:
H.Lu and J.Martí, J. Phys. Chem. Lett. 2020, 11, 9938−9945.
Compartir: